SIU: SACD2020;1507:011
Contacto Autor: g-daneri@hotmail.com
Aceptado: 05 de junio de 2020
Gustavo Daneri, Jefe de Departamento de Cirugía Digestiva1 y Profesor Titular de Cátedra de Clínica Quirúrgica I2;
Mayra Camio, residente de cirugía general.1
1Sanatorio Adventista del Plata, Entre Ríos, Argentina.
2Universidad Adventista del Plata, Entre Ríos, Argentina.
Resumen
Se presenta caso de paciente de 52 años con diagnóstico de peritonitis esclerosante, presumiblemente relacionado con traumatismo cerrado de abdomen, que debuta como suboclusión progresando a oclusión intestinal. Se realiza laparotomía, enterolisis y resección de membranas además de tratamiento inmunosupresor con tamoxifeno y corticoides.
Introducción
La peritonitis esclerosante encapsulante (PEE) o cocoon (capullo) abdominal es una rara enfermedad que se caracteriza por la formación de una membrana fibrocolagenosa de color blanco grisáceo, que recubre parcial (tipo I) o totalmente (tipo II) el intestino delgado, y puede extenderse para involucrar a otros órganos (tipo III) como el colon, el hígado y el estómago. Dicha membrana envuelve las asas de intestino delgado y llega a producir cuadros de obstrucción intestinal.1 Puede ser primaria (idiopático) o secundaria. Se ha informado de una forma secundaria de cocoon abdominal después de una amplia gama de causas, incluida la tuberculosis y la diálisis peritoneal.2
El tratamiento incluye tratar la causa principal si se identifica. Se ha sugerido el uso de esteroides y tamoxifeno en el tratamiento de algunos pacientes.3
En pacientes que no mejoran con un tratamiento conservador o aquellos con episodios recurrentes de obstrucción intestinal o complicaciones tales como perforación requieren intervención quirúrgica. El tratamiento quirúrgico puede incluir adhesiólisis con liberación de las membranas,26,29 plicatura del intestino delgado (plicatura de Noble),30,31 tratando de evitar al máximo las resecciones por la gran posibilidad de fracaso de las anastomosis. Existe un alto riesgo de enterotomías inadvertidas dada las densas y fibróticas adherencias entre asas intestinales, y mal estado nutricional del paciente, lo que podría conducir a fístulas enterocutáneas, además, también existe riesgo de obstrucción intestinal postoperatoria.4
Reporte de caso
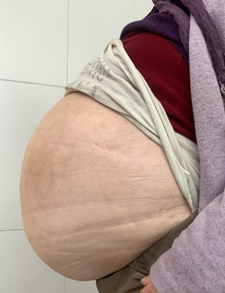
Masculino de 52 años, que consulta por cuadro de dispepsia postprandial de 3 meses de evolución asociado a pérdida de peso de 10 kg aproximadamente, agravándose en la última semana, presentando intolerancia a la vía oral con regurgitaciones y vómitos.
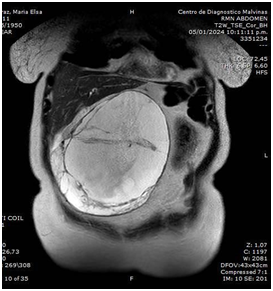
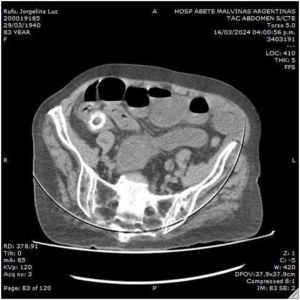
Se solicita rutina de laboratorio con perfil nutricional y videoendoscopía digestiva alta (VEDA), que evidencia esofagitis severa. La tomografía de abdomen (TCMS), detecta estrechamiento del duodeno en su tercera porción por compresión extrínseca coincidente con la raíz de la arteria mesentérica superior de probable origen fibrosante. Las asas intestinales delgadas se encuentran rodeadas por un engrosamiento del peritoneo visceral con aspecto de membrana respetando al ileon distal, asociado a colección ubicada en región centroabdominal infraumbilical. Presencia de ganglios reactivos (Fig 1 y 2).
Se realiza su internación para nutrición parenteral, al cabo de una semana se logran valores óptimos y se decide realizar laparotomía exploradora, mediante incisión mediana supra-infraumbilical, se observa estómago, hígado, intestino delgado y colon completamente encapsulados por membrana blanquecina, de consistencia rígida y compresiva, adherida a tejidos con zonas de calcificación. Se efectuá enterolisis, resección de membranas en los sitios factibles para descompresión del intestino (Fig 3). Se deja un drenaje en fondo de saco de Douglas y se coloca malla antiadherente SepraFilm (Fig 4).
El análisis histopatológico del material enviado de peritoneo parietal, visceral y epiplón informa cuadro compatible con peritonitis esclerosante o fibrosante con focos de calcificación distrófica.
Se requirieron 30 días de internación, con soporte nutricional parenteral perioperatorio y tratamiento con Tamoxifeno e hidrocortisona que luego realiza cambio a prednisona como tratamiento inmunosupresor y antifibroblastico.
Figura 1. TCMS abdominal con contraste: Corte axial (izq) y corte coronal (der) Las asas intestinales pequeñas están encerradas en un saco de membrana peritoneal gruesa con un pequeño volumen de líquido peritoneal. Se observa distensión gastroduodenal.

Figura 3. Imágenes de laparotomía exploradora que muestran intestino encerrado en saco membranoso que sugiere encapsulación peritoneal con la subsiguiente disección del mismo.

Figura 4. Imágenes de laparotomía exploradora que muestra secuencia de colocación de malla antiadherente posterior a adhesiólisis.
Discusión
La PEE es una afección adquirida como resultado de la inflamación peritoneal que puede desencadenarse por diversos factores (Tabla 1).5,6
Esta entidad clínica fue definida por primera vez en 1907 por Owtschinnikow, quien describió el recubrimiento de los intestinos por una membrana fibrocolágena.7,8 Considerando las propiedades morfológicas e histológicas de esta membrana, calificó esta condición de “peritonitis crónica fibrosa encapsulada”.7,9,10 Históricamente, la PEE se clasificó como primaria o secundaria, según su causa subyacente y las propiedades patogénicas de la membrana fibrocolágena.7,11,12 La forma idiopática de PEE también se ha denominado “síndrome de cocoon abdominal”, un término que fue utilizado por primera vez por Foo et al en 1978.7
El desarrollo de la PEE ha sido dividido desde el punto de vista clínico y patogénico en 4 etapas, según propusieron Nakamoto et al. (Tabla 2).33 La etapa pre-PEE se caracteriza por la presencia de fallo de ultrafiltración y/o alteraciones en el transporte de solutos, seguido por la fase inflamatoria, la encapsulante y la fase obstructiva, que se caracteriza por obstrucción intestinal y formación del cocoon
Tabla 1. Causas de PEE secundaria.
Dada la rareza y heterogeneidad de etiologías, se desconoce la incidencia y prevalencia de PEE en su conjunto.
El diagnóstico es clínico y puede confirmarse mediante imagenología ó laparotomía.
El tratamiento debe dirigirse a la afección subyacente, utilizando corticosteroides o tamoxifeno, solo o en combinación, según el estado de la enfermedad y las contraindicaciones, tratando de optimizar el estado nutricional. En pacientes que han fracasado en la terapia médica conservadora, se debe considerar el tratamiento quirúrgico.
Una revisión de series que involucraron cinco o más casos de PEE reveló un total de 118 casos.12-15 La edad media de los pacientes fue de 39 años, siendo la mayoría hombres (68%). El tipo I fue el hallazgo más común (43,4%). El síntoma predominante de presentación fue dolor abdominal (72%), seguido de distensión abdominal (44,9%) y masas abdominales (30,5%). En la mayoría de los pacientes el diagnóstico fue intraoperatorio (45,7%). Casi todos los pacientes fueron sometidos a exploración quirúrgica (99,2%); de estos, la cirugía incluyó la escisión de la membrana o la adhesiolisis (100%), junto con otros procedimientos como resección, anastomosis, plicatura mesentérica o colocación de stent intestinal. Los resultados fueron en general buenos, con obstrucción recurrente observada en solo el 5,9% de los pacientes. Un paciente fue tratado de forma conservadora y falleció debido a insuficiencia hepática; esta fue la única muerte reportada (0.8%). Los pacientes con tuberculosis abdominal (7,6%) recibieron una terapia adecuada con fármacos antituberculosos.
La evidencia en la literatura indica que es prudente tratar a los pacientes con síntomas abdominales mínimos de forma conservadora, con reposo intestinal, descompresión nasogástrica y soporte nutricional enteral o parenteral.7,13,16-18 Se recomienda la alimentación enteral para los pacientes que toleraran la via oral; cuando esto no sea factible, se debe considerar la nutrición parenteral.7,18 Mejorar el estado nutricional de estos pacientes es de suma importancia, ya que puede mejorar la respuesta al tratamiento conservador o evitar complicaciones quirúrgicas posteriores como infecciones y fístulas.7,13,18
Se puede iniciar el tratamiento farmacológico para pacientes que no responden al tratamiento conservador, con tamoxifeno, esteroides, colchicina, azatioprina y ácido micofenólico.6,7,16-19 El tamoxifeno actúa como un modulador del receptor de estrógenos que inhibe la producción fibroblástica del factor de crecimiento transformante beta, mientras que los esteroides inhiben la síntesis y la maduración del colágeno al suprimir el proceso inflamatorio dentro de la membrana peritoneal.7,16,19 Por otro lado, la colchicina inhibe la expresión del ácido ribonucleico, mensajero del factor transformante beta, exhibiendo así una acción anti-inflamatoria.16,19 Cornelis et al20 reportaron que los corticosteroides y el tamoxifeno son útiles para prevenir y/o tratar la PEE. Solak et al19 informaron el uso exitoso de un esteroide asociado a ácido micofenólico en un paciente con síntomas recurrentes después de una operación quirúrgica por PEE idiopática. Malik et al21 administraron esteroides postoperatorios de manera similar.
También se ha logrado el éxito con estos medicamentos para pacientes con intervenciones quirúrgicas fallidas previas, en las que no se pudo lograr la escisión completa de las membranas y la adhesiolisis.6,22 Además, los pacientes que continúan teniendo síntomas postoperatorios recurrentes también pueden beneficiarse del uso de estas drogas.23
Los pacientes con síntomas graves de obstrucción intestinal, aquellos con abdomen virgen y aquellos que no responden al tratamiento conservador pueden ser candidatos para intervenciones quirúrgicas.
Las opciones quirúrgicas incluyen escisión de membrana más adhesiolisis o, para pacientes con lesión intestinal, resección más anastomosis con o sin enterostomía protectora. Una parte importante de la cirugía es la escisión completa de la membrana; esto asegura una reducción en la tasa de recurrencia,7,12,13,16,24,25 evitando las lesiones intestinales, lo que agrava el pronóstico de estos pacientes7,12
En la mayoría de los casos, la enterotomía sería la reparación primaria, mientras que la resección intestinal se reserva para casos con lesiones extensas o pérdida de la integridad vascular del intestino. La resección, particularmente cuando no está obviamente indicada, podría dar como resultado una mayor morbilidad y mortalidad para estos pacientes.12,13,16 Kawanishi et al. informaron una tasa de mortalidad del 4% entre los pacientes PEE secundaria a diálisis peritoneal que se sometieron a adhesiolisis sola, en comparación con el 82% de los que se sometieron a una enterectomía y anastomosis en un estudio separado.26
Después de la extirpación completa de la membrana, colocar sustancias antiadhesivas entre las asas intestinales antes de cerrar el abdomen puede reducir el riesgo de adherencias postoperatorias;12,13,16 sin embargo, el efecto de estas sustancias en pacientes con membranas parcialmente extirpadas es discutible.16
La laparoscopia no es parte del abordaje quirúrgico estándar en pacientes con PEE. Un número limitado de informes de casos ha descrito una escisión y adhesiolisis de membrana laparoscópica exitosa.27 Una ventaja de la laparoscopía es que puede usarse con fines diagnósticos y terapéuticos en pacientes con un diagnóstico poco claro después de las pruebas apropiadas.28 Existe un riesgo potencial de lesión intestinal durante la inserción de los trocares, separación y o resección de la membrana del intestino subyacente, lo primero podría reducirse utilizando la técnica abierta para confección del neumoperitoneo.
Conclusión
Luego de examinar las causas más frecuentes desencadenantes de esta patología, como son la diálisis peritoneal, tuberculosis y/o consumo de ciertos fármacos, realizamos una exhaustiva anamnesis, rescatando como dato sumamente importante un traumatismo cerrado de abdomen de mediana intensidad provocada por cabezazo de equino que no requirió internación, pero que consideramos a nuestro entender la causa desencadenante de la misma. Luego de la cirugía continuó en controles y tratamiento por seis meses con Prednisona y un año con tamoxifeno, llevando a la actualidad alrededor de cuatro años sin síntomas.
En 1968, Black publicó un caso de peritonitis esclerosante, posterior a traumatismo abdominal cerrado en una niña de 8 años, estableciendo una probable relación con el hemoperitoneo.32
El cocoon abdominal, aunque raro, es una afección benigna y tratable. Debe considerarse como diagnóstico diferencial en pacientes que presentan síntomas de obstrucción intestinal intermitente. Las imágenes preoperatorias, como TC y RMN pueden ayudar a confirmar el diagnóstico. Un alto índice de sospecha es crítico para hacer el diagnóstico correcto.
Bibliografía
- Bujalance F, H. N. (2007). Tratamiento quirúrgico de la peritonitis esclerosante. Cir Esp, 81(3), 139-43.
- Sharma V, S. H. (2017). Tubercular abdominal cocoon: systematic re-view of an uncommon form of tuberculosis. Surg Infect, 18: 736–741.
- Danford CJ, Lin SC, Smith MP, Wolf JL (2018) Encapsulating peritoneal sclerosis. World J Gastroenterol, 24:3101–3111.
- Li S, Wang JJ, Hu WX, Zhang MC, Liu XY, Li Y, Cai GF, Liu SL, Yao XQ (2017). Diagnosis and treatment of 26 cases of abdominal cocoon. World J Surg, 41:1287–1294.
- Browne LP, Patel J, Guillerman RP, Hanson IC, Cass DL (2012). Abdominal cocoon: a unique presentation in an immunodeficient infant. Pediatr Radiol, 42: 263-266.
- Da Luz MM, Barral SM, Barral CM, Bechara Cde S, LacerdaFilho A.(2011). Idiopathic encapsulating peritonitis: report of two cases. Surg Today, 41: 1644-1648.
- Tannoury JN, Abboud BN.(2012). Idiopathic sclerosing encapsulating peritonitis: abdominal cocoon. World J Gastroenterol, 18: 1999-2004.
- Tasdelen N, Demirag A, Kalayci M, Gurses M, Kilickesmez NO, Comunoglu N, Gurmen AN. (2009). Intestinal obstruction due to abdominal cocoon: CT findings. Eur J Radiol Extra, 70: 79-e81.
- Gupta S, Gupta A, Yadav C, Dwiverdi A. (2013). Abdominal Cocoon: Case Report and Literature Review. Sch J App Med Sci, 1: 748-52.
- Kumar J, Garg A, Chowdhury V, Prakash A, Singh S. (2012). Abdominal cocoon: a rare case of intestinal obstruction. A report of two cases. Arab J Gastroenterol, 13: 188-190.
- Naik RP, Joshipura VP, Patel NR, Chavda HJ. (2010). Encapsulating sclerosing peritonitis. Trop Gastroenterol, 31: 235-237.
- Wei B, Wei HB, Guo WP, Zheng ZH, Huang Y, Hu BG, Huang JL. (2009). Diagnosis and treatment of abdominal cocoon: a report of 24 cases. Am J Surg, 198: 348-353.
- Li N, Zhu W, Li Y, Gong J, Gu L, Li M, et al. (2014). Surgical treatment and perioperative management of idiopathic abdominal cocoon: Single-center review of 65 cases. World J Surg, 38:1860–7.
- Xu P, Chen LH, Li YM.(2007). Idiopathic sclerosing encapsulating peritonitis (or abdominal cocoon): A report of 5 cases. World J Gastroenterol, 13:3649–51.
- Singh B, Gupta S. (2013). Abdominal cocoon: A case series. Int J Surg, 11:325–8.
- Akbulut S. (2015). Accurate definition and management of idiopathic sclerosing encapsulating peritonitis. World J Gastroentrol, 21:675–87.
- Candido PC, Werner AF, Pereira IM, Matos BA, Pfeilsticker RM, Filho RS. (2015). Sclerosing encapsulating peritonitis: A case report. Radiol Bras, 48:56–8.
- Habib SM, Betjes MG, Fieren MW, Boeschoten EW, Abrahams AC, Boer WH, et al. (2011). Management of encapsulating peritoneal sclerosis: A guideline on optimal and uniform treatment. Neth J Med, 69:500–7.
- Solak A, Solak İ. (2012). Abdominal cocoon syndrome: Preoperative diagnostic criteria, good clinical outcome with medical treatment and review of the literature. Turk J Gastroenterol, 23:776–9.
- Cornelis T, Oreopoulos DG. (2011). Update on potential medical treatments for encapsulating peritoneal sclerosis: Human and experimental data. Int Urol Nephrol, 43:147–56.
- Malik SA, Javed MA, Mian MA. (2012). Abdominal cocoon (sclerosing encapsulating peritonitis): a rare cause of intestinal obstruction. J Coll Physicians Surg Pak, 22: 171-173.
- Wang Q, Wang D. (2010). Abdominal cocoon: multi-detector row CT with multiplanar reformation and review of literatures. Abdom Imaging, 35: 92-94.
- Rasihashemi SZ, Ramouz A, Ebrahimi F. (2014). An unusual small bowel obstruction (abdominal cocoon): a case report. Arq Bras Cir Dig, 27: 82-83.
- Shah MY, Gedam BS, Sonarkar R, Gopinath KS. (2013). Abdominal cocoon: An unusual cause of subacute intestinal obstruction. Indian J Surg, 75:391–3.
- Hong KD, Bae JH, Jang YJ, Jung HY, Cho JH, Choi JY, et al. (2013). Encapsulating peritoneal sclerosis: Case series from a university center. Korean J Intern Med, 28:587–93.
- Kawanishi H, Watanabe H, Moriishi M, Tsuchiya S. (2005). Successful surgical management of encapsulating peritoneal sclerosis. Perit Dial Int, 25:S39–47.
- Ertem M, Ozben V, Gok H, Aksu E. (2011). An unusual case in surgical emergency: Abdominal cocoon and its laparoscopic management. J Minim Access Surg, 7: 184-186.
- Meshikhes AW, Bojal S. (2012). A rare cause of small bowel obstruction: Abdominal cocoon. Int J Surg Case Rep, 3: 272-274.
- Kawanishi H, Moriishi M, Tsuchiya S.(2006) Experience of 100 surgical cases of encapsulating peritoneal sclerosis: investigation of recurrent cases after surgery. Adv Perit Dial, 22:60-4.
- Kawanishi H, Ide K, Yamashita M, Shimomura M, Moriishi M, Tsuchiya S, et al (2008). Surgical techniques for prevention of recurrence after total enterolysis in encapsulating peritoneal sclerosis. Adv Perit Dial, 24:51-5.
- Kawanishi H, Shintaku S, Moriishi M, Dohi K, Tsuchiya S. (2011) Seventeen years’ experience of surgical options for encapsulating peritoneal sclerosis. Adv Perit Dial, 27:53-8.
- Black W, Nelson D, Walker W. (1968) Multifocal subperitoneal sclerosis. Surgery, 68:706-710
- Nakamoto H.(2005) Encapsulating peritoneal sclerosis: a clinician’s approach to diagnosis and medical treatment. Perit Dial Int, 25 (4):S30-8