SIU: SACD2020;1501:004
Autor de contacto: g-daneri@hotmail.com
Aceptado: 05 de Enero de 2019
Gustavo Daneri, médico especialista en cirugía general y gastroenterológica1; Mayra Camio, residente de cirugía general1;
1Sanatorio Adventista del Plata, Entre Ríos, Argentina
Resumen
Se presenta caso de paciente de 63 años con diagnóstico de adenocarcinoma gástrico que presenta regresión histopatológica completa posterior a quimioterapia neoadyuvante con esquema FLOT4. Se realiza revisión de la literatura que justifique tratamiento.
Introducción
El cáncer gástrico es la quinta neoplasia maligna más común en todo el mundo y la tercera causa de mortalidad relacionada con el cáncer.1 El pronóstico es pobre. La resección endoscópica o quirúrgica es curativa en aproximadamente el 90% de los tumores en estadio temprano (T1), pero la supervivencia disminuye drásticamente para tumores más avanzados (T2–4) o para aquellos con afectación de ganglios linfáticos regionales.2 La quimioterapia perioperatoria ha demostrado mejorar la supervivencia. El esquema FLOT4, consiste en cuatro ciclos de quimioterapia basada en la combinación de fluorouracilo, leucovorina, oxaliplatino y docetaxel, administrado cada dos semanas. Diferentes estudios han demostrado que este esquema es superior a otros, aumentando significativamente las tasas de cirugía curativa, la mediana de supervivencia y la regresión histopatológica, especialmente en pacientes con tumores de tipo intestinal.3
Reporte del caso
Masculino de 63 años, con antecedente de hipertensión, dislipemia, diabetes y nefrectomía parcial izquierda por tumor de células claras, que consulta por dispepsia, vómitos y dolor en flanco y fosa ilíaca izquierda. La videoendoscopía digestiva alta (VEDA) evidencia cuerpo gástrico disminuido de calibre, mucosa intensamente congestiva, friable y pliegues engrosados que no distienden con la insuflación. La anatomía patológica (AP) muestra gastritis crónica moderada, con focos de atrofia glandular por metaplasia intestinal completa, helicobacter pylori negativo, infiltración de lámina propia y mucosa por carcinoma pobremente cohesivo de tipo difuso. La neumotomografía (Neumo TCMS) detecta engrosamiento gástrico circunferencial que provoca estenosis y rigidez con dificultad en la distensión gástrica, dicha lesión tiene una longitud aproximada de 119 mm y un espesor parietal de 17 mm; el compromiso abarca parte del cuerpo gástrico, antro y píloro, con compromiso de curvatura menor y lesión llegando a 17 mm del cardias. Se observa neovascularización perilesional y múltiples adenopatías, tanto en la curvatura menor como en la curvatura mayor, siendo las de mayor tamaño en curvatura menor de 10 mm de diámetro y en curvatura mayor 12 mm; también se observa pequeñas adenopatías en relación con el hilio esplénico (Figura 1 y 2).


Según estadificación clínica (cTNM) se interpreta como T3N3M0. El paciente realiza cuatro sesiones de neoadyuvancia con esquema FLOT4 cada 14 días y se reevalúa. La VEDA evidencia cuerpo gástrico tunelizado, mucosa friable, irregular, con presencia de erosiones difusas; AP muestra infiltración de lámina propia y mucosa por un carcinoma pobremente diferenciado. Se realiza inmunohistoquímica, necesaria para establecer con certeza el sitio primario de origen de la neoplasia, riñón o estómago, los hallazgos sugieren neoplasia de origen gástrico. Neumo TCMS que muestra buena distensibilidad, gástrica con marcada disminución del compromiso parietal por la lesión, persistiendo zona de engrosamiento e irregularidad que compromete la región anteroinferior del antro con una longitud aproximada de 78,9 mm y un espesor de 6,4 mm se constata moderada disminución de la hipervascularización de la curvatura menor y de la región subyacente al antro gástrico, en dichas áreas también se observa reducción en el número y tamaño de los ganglios mencionados en el estudio previo, actualmente el ganglio de mayor tamaño en zona de curvatura menor es de 8,2 mm. Y en la región periférica al antro gástrico se visualiza actualmente una sola imagen ganglionar que mide 5,2 mm (Figura 3 y 4).
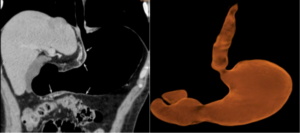

Según la estadificación post neoadyuvancia (yTNM) se interpreta como T1N0M0. Se decide realizar gastrectomía total D2 híbrida, con anastomosis mecánica esófago yeyunal en Y de Roux, más yeyunostomía de alimentación. En la biopsia por congelación no se reconoce tumor macroscópico y la evaluación del margen quirúrgico esofágico es negativo para neoplasia, con gastritis crónica y metaplasia intestinal. El paciente requirió nueve días de internación, incluyendo las primeras 48 horas en unidad de terapia intensiva. No presentó complicaciones. El resultado de AP diferido informa márgenes de sección quirúrgica y epiplón mayor libres de compromiso neoplásico. Nueve ganglios de curvatura mayor, treinta y dos ganglios de curvatura menor, grupo 7, 8 y 9 negativos para metástasis.
Discusión
En las últimas décadas, la supervivencia de los pacientes con cáncer gástrico ha mejorado significativamente; sin embargo, el cáncer gástrico en etapa temprana potencialmente resecable aún conlleva una mortalidad significativa, ya que solo un tercio de estos pacientes con enfermedad localmente avanzada sobreviven más de 5 años.4
El manejo de esta enfermedad mortal ha evolucionado debido a la incorporación de mejores técnicas de estadificación, abordaje quirúrgico, tratamiento sistémico efectivo y secuenciación de diferentes modalidades terapéuticas.5
Existen algunas diferencias globales en cómo se maneja y se trata el cáncer gástrico loco-regional. En Estados Unidos y algunas partes de Europa, la quimioterapia perioperatoria es el tratamiento de preferencia. Sin embargo, en Asia, la quimioterapia adyuvante después de la resección quirúrgica D2 se considera tratamiento estándar.6-8
El impacto positivo de la quimioterapia neoadyuvante en la supervivencia de pacientes con adenocarcinoma gástrico localmente avanzado se ha vuelto más claro con el tiempo, aunque no hay consenso sobre el mejor enfoque.
Con base en evidencia reciente, el tratamiento perioperatorio con el régimen de quimioterapia triplete FLOT4 (5FU, leucovorina, oxaliplatino, docetaxel) es el régimen preferido.9
Al-Batran et al10, comparó dos enfoques diferentes de quimioterapia de manera perioperatoria para los cánceres gástricos y de unión esófago gástrica (UEG). El grupo de estudio incluyó cuatro ciclos de FLOT que comparó con tres ciclos de epirubicina, cisplatino y 5FU (o capecitabina) (ECF / ECX) administrados antes y después de la resección. Hubo más pacientes que lograron resección R0 en FLOT, 84% comparado con 77% en ECF / ECX, presentando mejoría significativa en la supervivencia global media de 50 y 35 meses respectivamente. Las complicaciones perioperatorias fueron similares en cada esquema.
Otro estudio observacional11, compara la efectividad del régimen FLOT, versus cirugía inicial seguida de quimioterapia en pacientes con cáncer gástrico T3-4 localmente avanzado. Se incluyó por lo menos un ciclo del esquema FLOT y lo repitieron cada 2 semanas, seguido por cirugía 3 semanas después de completar la quimioterapia en el grupo de neoadyuvancia. El grupo que realizó neoadyuvancia mostró una supervivencia global favorable en comparación con el grupo que realizo cirugía inicial y las tasas de supervivencia a 3 años fueron 58.7% y 30.9% respectivamente. Sin embargo, el efecto FLOT fue bajo en pacientes sin metástasis en los ganglios linfáticos.
Homann et al12, realizó un estudio para determinar la tasa de remisión patológica y evaluar la posible relación entre ésta y el resultado clínico. El grupo de estudio incluyó 3-4 ciclos del esquema FLOT y lo repitieron cada 2 semanas, seguido por cirugía 3-5 semanas después de completar la quimioterapia. Todos los pacientes tenían estadios clínicos T3 y/o N1 y 11 (23,9%) tenían metástasis a distancia (M1). 8 de 46 pacientes (17.4%) lograron un remisión patológica completa, la cual fue más alta en tumores de histología de tipo intestinal (30.8%) y en aquellos ubicados en la UEG (30.4%) y más baja en pacientes con tumores de tipo difuso / mixto (0%) o tumores ubicados en el estómago (4.3%). Los pacientes con remisión patológica completa tuvieron una probabilidad del 100% de supervivencia general y libre de enfermedad durante el período de observación, que fue significativamente mayor que la probabilidad de supervivencia en pacientes sin remisión patológica completa.
Hay muchos beneficios potenciales de administrar quimioterapia sistémica preoperatoria a pacientes con cáncer gástrico.9 Una de las principales ventajas es reducir el tamaño del tumor, lo que a su vez ayudará a realizar la resección R0. Esto es especialmente importante en tumores grandes y voluminosos localmente avanzados en el momento del diagnóstico inicial, cuando la resección curativa es difícil de realizar. Otra ventaja potencial es determinar el comportamiento natural del tumor durante la fase de tratamiento preoperatorio, como pacientes con alto riesgo de la metástasis a distancia puede evitar la gastrectomía si el cáncer hace metástasis después o durante la quimioterapia preoperatoria. De esta manera, la morbilidad y la mortalidad relacionadas con la gastrectomía se pueden evitar en tales pacientes. Y, por último, la administración de quimioterapia preoperatoria brindará la mejor oportunidad de administrar un tratamiento sistémico máximo, ya que algunos pacientes pueden no ser capaces de completar la quimioterapia adyuvante debido al retraso en la recuperación de la cirugía.
Por lo tanto, es una práctica común hacer quimioterapia perioperatoria en lugar de cirugía inicial, especialmente para los cánceres gástricos T2 y superiores o con ganglios positivos.
Bibliografía
- Bray F, F. J. (2018). Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries . CA Cancer J Clin, 68(6):394–424.
- Reim D, L. M. (2013). Prognostic implications of the seventh edition of the International Union Against Cancer classifi cation for patients with gastric cancer: the Western experience of patients treated in a single-center European institution. J Clin Oncol , 31:263–71.
- Davies AR, G. J. (2014). Tumor stage after neoadjuvant chemotherapy determines survival after surgery for adenocarcinoma of the esophagus and esophagogastric junction. J Clin Oncol Off J Am Soc Clin Oncol, 32(27):2983–90.
-
SEER. (1 de Agosto de 2018). Cancer statistics: survival by stage in stomach cancer. Obtenido de https://seer.cancer.gov/ statfacts/html/stomach.html.
- Schmidt B, Y. S. (2013). D1 versus D2 lymphadenectomy for gastric cancer. J Surg Oncol, 107(3):259–64.
- Association, J. G. (2017). Japanese gastric cancer treatment guidelines. Gastric cancer, 20(1):1–19.
- Raigani S, H. J. (2014). Trends in the surgical treatment of gastric adenocarcinoma. Ann Surg Oncol, 21(2):569–74.
- Smyth EC, V. M. (2016). Gastric cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow up. Ann Oncol, 27(5): v38–49.
-
Khan U, S. M. (2019). Optimizing Therapies in the Perioperative Management of Gastric Cancer. Curr. Treat. Options in Oncol, 20: 57.
- Al-Batran SE, H. R. (2016). Oxaliplatin, fluorouracil, and leucovorin versus epirubicin, cisplatin, an fluorouracil or capecitabine in patients with resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4-AIO): results from the phase 2 part of a multicentre, open-label, randomised phase 2/3 trial. Lancet Oncol, 17:1697-708. 10.1016/S1470-2045(16)30531-9.
- Wang K, R. Y. (2019). Docetaxel, oxaliplatin, leucovorin, and 5-fluorouracil (FLOT) as preoperative and postoperative chemotherapy compared with surgery followed by chemotherapy for patients with locally advanced gastric cancer: a propensity scorebased analysis. Cancer Manag Res, 11:3009-3020.
-
Homann N, P. C.-B. (2012). Pathological complete remission in patients with oesophagogastric cancer receiving preoperative 5-fluorouracil, oxaliplatin and docetaxel. Int J Cancer, 130(7):1706-13.